ไม่ได้ส่งคำตอบ
0.0
จากการวิเคราะห์ปุ๋ยตัวอย่างชนิดนี้ปริมาณ 0.3 g พบว่าในการไทเทรต ใช้ NaOH ไป 3.40 mL จงคำนวณหา %(w/w) urea ในปุ๋ยตัวอย่าง
ข้อมูล atomic weight (g/mol) ของธาตุต่างๆมีดังนี้: C = 12, O = 16, N = 14, H = 1
เลือกคำตอบ โดยเลือกตอบเฉพาะตัวเลข 1-8 ที่อยู่หน้าตัวเลือกดังต่อไปนี้
1. 12 %(w/w) urea
2. 24 %(w/w) urea
3. 36 %(w/w) urea
4. 48 %(w/w) urea
5. 60 %(w/w) urea
6. 72 %(w/w) urea
7. 84 %(w/w) urea
8. 96 %(w/w) urea
ตอบ 4. 48 %(w/w) urea
แนวคิด
คำนวณย้อนกลับจากผลการวิเคราะห์ที่ได้
สมการเคมีที่เกี่ยวข้องประกอบด้วย
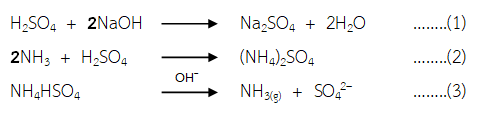
หา mol ของกรด H2SO4 ทั้งหมด (เริ่มต้น) = (0.05 M)(50 mL)/(1000) = 2.5x10-3 mol
หา mol ของ H2SO4 ที่เหลือ โดยการไทเทรตกับ NaOH
จากสมการที่ (1) NaOH 2 mol ทำปฏิกิริยาพอดีกับ H2SO4 1 mol
ดังนั้น จากการไทเทรต mol ของ H2SO4 ที่ทำปฏิกิริยากับ NaOH = (0.05 M)(3.4 mL)/(1000)(2) = 8.5x10-5 mol
ดังนั้น mol ของ H2SO4 ที่ทำปฏิกิริยากับ NH3 = (2.5x10-3) - (8.5x10-5) = 2.415x10-3 mol
หา mol ของ NH3 ที่ถูกจับด้วย H2SO4
จากสมการที่ (2) H2SO4 1 mol ทำปฏิกิริยาพอดีกับ NH3 2 mol
ดังนั้น mol NH3 ที่จับได้ = (2.415x10-3 mol)(2) = 4.83x10-3 mol
หา urea ในปุ๋ย
จากการสลายตัว urea 1 mol จะให้ NH4HSO4 2 mol
และจากสมาการที่ (3) NH4HSO4 1 mol จะให้ NH3 1 mol
ดังนั้น 2 mol ของ NH3 มาจาก 1 mol ของ urea
4.83x10-3 mol ของ NH3 มาจาก (4.83x10-3)/2 mol ของ urea
หรือ คิดเป็น 2.415x10-3 mol ของ urea
น้ำหนักของ urea ที่วิเคราะห์ได้ คือ (2.415x10-3 mol)(60 g/mol) = 0.1449 g
%(w/w) urea = (0.1449/0.3) $\times$ 100 = 48.3%
ปัดทศนิยมทิ้ง ดังนั้น คำตอบคือ 48%